QUÍMICA I
Correo: maestromemo@gadi.edu.mx
EVALUACIÓN
Para la evaluación de esta materia:
30% Tareas 35% Participaciones en clase 10% Cuestionario 25% Evaluación Final
OBJETIVO: Desarrollar los conceptos fundamentales de la Química, para identificar y comprender la variedad de compuestos inorgánicos que permita entender el medio que nos rodea y su relación con otras ciencias.
INICIO CLASE 1, 24/ABRIL/24
UNIDAD IQUÍMICA COMO HERRAMIENTA DE VIDA, E INTERRELACIÓN ENTRE MATERIA Y ENERGÍA
Analizar La relación entre materia y energía a partir de sus propiedades y características para comprender su relación con los fenómenos físicos y químicos.
LA CIENCIA Y EL MÉTODO CIENTÍFICO
QUÍMICA COMO HERRAMIENTA DE VIDA, E INTERRELACIÓN ENTRE MATERIA Y ENERGÍA
Analizar La relación entre materia y energía a partir de sus propiedades y características para comprender su relación con los fenómenos físicos y químicos.
LA CIENCIA Y EL MÉTODO CIENTÍFICO
La química es una ciencia. La ciencia es el conocimiento organizado o sistematizado que se ha reunido mediante la utilización del método científico. Este método comprende tres pasos:
1. La reunión de hechos y datos mediante la observación de eventos bajo condiciones cuidadosamente controladas –experimentación.
2. El examen y la correlación de estos hechos a fin de proponer una hipótesis. Una hipótesis es una teoría tentativa para explicar los datos.
3. La planeación y ejecución de una experimentación más amplia para apoyar o rechazar la hipótesis, y proponer una teoría o ley científica si fuera posible.
DEFINICIÓN DE QUÍMICA
" es la ciencia que estudia las sustancias, su estructura (tipos y formas de acomodo de los átomos), sus propiedades y las reacciones que las transforman en otras sustancias."Linus Pauling (1901-1994)
Históricamente, esta ciencia surgió de la alquimia y, en su evolución inicial, se dividió en dos ramas que aún existen:
· La química orgánica, que estudia las sustancias basadas en la combinación de los átomos de carbono e incluye a los hidrocarburos y sus derivados, los productos naturales y hasta los tejidos vivos y
· La química inorgánica se centra en el estudio de los minerales.
Hoy en día estas definiciones se han ampliado y diversificado; así se pueden encontrar otros campos de la química como la química industrial, la química analítica y la físicoquímica. La separación entre lo orgánico e inorgánico se desvanece, ya que cada vez más la biología es parte importante de la química, esto se ilustra bien en campos como los biomateriales y la nanotecnología.
Dentro de su área de estudio, los químicos trabajan en diversos tipos de problemas que pueden clasificarse como pertenecientes a una de las cinco subáreas de la química:
1) química orgánica, (2) química inorgánica, (3) química analítica, (4) química física, y (5) bioquímica.
SUBÁREA
Química orgánica
Química inorgánica
Química analítica
Química física
Bioquímica
MATERIA
Estudia las sustancias que contienen carbono.
Estudia las sustancias que no contienen carbono.
Estudia la composición de una muestra (cualitativa) y cuanto contiene (cuantitativa).
Estudia las estructuras de las sustancias, la rapidez con que cambian (cinética) y el papel del calor en los cambios químicos (termodinámica.
Estudia las reacciones químicas en los sistemas vivos.
EJEMPLO
Preparación de la aspirina (C9H8O4) o Tylenol (C8N9NO2).
La comprensión del funcionamiento de la batería de un auto.
La medición de la cantidad de un pesticida específico en las aguas freáticas.
La comprensión de los cambios que se presentan cuando se funde el hielo para obtener agua líquida.
La comprensión del mecanismo de fragmentación de algunos alimentos por la saliva cuando los masticamos.
MATERIA
El universo físico esta hecho exclusivamente de materia y energía. La materia es de lo que están hechos todos los objetos materiales. La materia tiene masa, la masa es una medida de la cantidad de materia que un objeto contiene. El peso es la fuerza de atracción entre nuestro planeta y la masa en cuestión, el peso varía con la gravedad.
Ejemplo: En Marte la gravedad es la tercera parte de la gravedad terrestre, en cambio, en Júpiter la gravedad es 2.4 veces la gravedad terrestre. Si en la tierra un hombre tiene una masa de 60 kilogramos. a) ¿Cual es su masa en Marte y Júpiter? b) ¿Cuál es su peso en Marte y Júpiter?
Solución:
a) Como la masa no cambia, tanto en Marte y Júpiter tendrá una masa de 60 kg.
b) Como el peso varía con la gravedad, en Marte pesará , y en Júpiter pesará .
PROPIEDADES FÍSICAS Y QUÍMICAS
Las propiedades químicas describen como reacciona una sustancia con otras sustancias. Las propiedades químicas de las sustancias se manifiestan necesariamente como cambio de composición. Cuando el azufre se quema (se combina con el oxígeno) formas un gas acre llamado dióxido de azufre. También se puede combinar con carbono para formar un líquido llamado bisulfuro de carbono, y con hierro para formar un sólido llamado bisulfuro de hierro. El dióxido de azufre, el bisulfuro de carbono y el bisulfuro de hierro tienen propiedades distintas a las del azufre. Cada una de estas sustancias tiene una composición diferente. Cuando las sustancias sufren un cambio en sus propiedades químicas decimos que ha ocurrido un cambio químico.
Las propiedades físicas son aquellas propiedades que se pueden observar y especificar sin hacer referencia a alguna otra sustancia. Las características como el olor, la dureza, la densidad, el punto de ebullición y el de fusión son propiedades físicas. Una propiedad física del azufre, por ejemplo, es que es un sólido amarillo, frágil en condiciones ordinarias. Otra propiedad es que el azufre es más denso que el agua. El azufre se funde a 115 °C. Cuando el azufre se funde ocurre un cambio físico debido a que su composición no cambia.
ELEMENTOS Y COMPUESTOS
Una sustancia pura es una sustancia química individual que se compone íntegramente de la misma clase de materia, puede ser un elemento o un compuesto. Por ejemplo, agua, diamante (carbono), sal, azúcar, etc.
Los elementos son las sustancias fundamentales con las que se construyen todas las cosas materiales. La partícula más pequeña que conserva las propiedades del elemento se llama átomo. Todos los átomos del mismo elemento tienen igual número atómico. Un átomo no se puede descomponer para dar átomos mas sencillos (excepto en la fisión nuclear). Ejemplos: Oro (Au), potasio (K), sodio (Na), cloro (Cl), etc.
Los compuestos son sustancias puras que están formados por uno o más elementos combinados en proporciones fijas. Las propiedades de los compuestos son distintas a las de los elementos individuales que intervienen. Ejemplo: Agua (H2O), sal (NaCl), Ácido Sulfúrico (H2SO4), etc.
COMPOSICIÓN DE ALGUNOS COMPUESTOS COMUNES
La química es una ciencia. La ciencia es el conocimiento organizado o sistematizado que se ha reunido mediante la utilización del método científico. Este método comprende tres pasos:
1. La reunión de hechos y datos mediante la observación de eventos bajo condiciones cuidadosamente controladas –experimentación.
2. El examen y la correlación de estos hechos a fin de proponer una hipótesis. Una hipótesis es una teoría tentativa para explicar los datos.
3. La planeación y ejecución de una experimentación más amplia para apoyar o rechazar la hipótesis, y proponer una teoría o ley científica si fuera posible.
DEFINICIÓN DE QUÍMICA
" es la ciencia que estudia las sustancias, su estructura (tipos y formas de acomodo de los átomos), sus propiedades y las reacciones que las transforman en otras sustancias."Linus Pauling (1901-1994)
Históricamente, esta ciencia surgió de la alquimia y, en su evolución inicial, se dividió en dos ramas que aún existen:
· La química orgánica, que estudia las sustancias basadas en la combinación de los átomos de carbono e incluye a los hidrocarburos y sus derivados, los productos naturales y hasta los tejidos vivos y
· La química inorgánica se centra en el estudio de los minerales.
Hoy en día estas definiciones se han ampliado y diversificado; así se pueden encontrar otros campos de la química como la química industrial, la química analítica y la físicoquímica. La separación entre lo orgánico e inorgánico se desvanece, ya que cada vez más la biología es parte importante de la química, esto se ilustra bien en campos como los biomateriales y la nanotecnología.
Dentro de su área de estudio, los químicos trabajan en diversos tipos de problemas que pueden clasificarse como pertenecientes a una de las cinco subáreas de la química:
1) química orgánica, (2) química inorgánica, (3) química analítica, (4) química física, y (5) bioquímica.
SUBÁREA Química orgánica
Química inorgánica Química analítica
Química física
Bioquímica
| MATERIA Estudia las sustancias que contienen carbono.
Estudia las sustancias que no contienen carbono. Estudia la composición de una muestra (cualitativa) y cuanto contiene (cuantitativa). Estudia las estructuras de las sustancias, la rapidez con que cambian (cinética) y el papel del calor en los cambios químicos (termodinámica. Estudia las reacciones químicas en los sistemas vivos.
| EJEMPLO Preparación de la aspirina (C9H8O4) o Tylenol (C8N9NO2). La comprensión del funcionamiento de la batería de un auto. La medición de la cantidad de un pesticida específico en las aguas freáticas. La comprensión de los cambios que se presentan cuando se funde el hielo para obtener agua líquida. La comprensión del mecanismo de fragmentación de algunos alimentos por la saliva cuando los masticamos. |
MATERIA
El universo físico esta hecho exclusivamente de materia y energía. La materia es de lo que están hechos todos los objetos materiales. La materia tiene masa, la masa es una medida de la cantidad de materia que un objeto contiene. El peso es la fuerza de atracción entre nuestro planeta y la masa en cuestión, el peso varía con la gravedad.
Ejemplo: En Marte la gravedad es la tercera parte de la gravedad terrestre, en cambio, en Júpiter la gravedad es 2.4 veces la gravedad terrestre. Si en la tierra un hombre tiene una masa de 60 kilogramos. a) ¿Cual es su masa en Marte y Júpiter? b) ¿Cuál es su peso en Marte y Júpiter?
Solución:
a) Como la masa no cambia, tanto en Marte y Júpiter tendrá una masa de 60 kg.
b) Como el peso varía con la gravedad, en Marte pesará , y en Júpiter pesará .
PROPIEDADES FÍSICAS Y QUÍMICAS
Las propiedades químicas describen como reacciona una sustancia con otras sustancias. Las propiedades químicas de las sustancias se manifiestan necesariamente como cambio de composición. Cuando el azufre se quema (se combina con el oxígeno) formas un gas acre llamado dióxido de azufre. También se puede combinar con carbono para formar un líquido llamado bisulfuro de carbono, y con hierro para formar un sólido llamado bisulfuro de hierro. El dióxido de azufre, el bisulfuro de carbono y el bisulfuro de hierro tienen propiedades distintas a las del azufre. Cada una de estas sustancias tiene una composición diferente. Cuando las sustancias sufren un cambio en sus propiedades químicas decimos que ha ocurrido un cambio químico.
Las propiedades físicas son aquellas propiedades que se pueden observar y especificar sin hacer referencia a alguna otra sustancia. Las características como el olor, la dureza, la densidad, el punto de ebullición y el de fusión son propiedades físicas. Una propiedad física del azufre, por ejemplo, es que es un sólido amarillo, frágil en condiciones ordinarias. Otra propiedad es que el azufre es más denso que el agua. El azufre se funde a 115 °C. Cuando el azufre se funde ocurre un cambio físico debido a que su composición no cambia.
ELEMENTOS Y COMPUESTOS
Una sustancia pura es una sustancia química individual que se compone íntegramente de la misma clase de materia, puede ser un elemento o un compuesto. Por ejemplo, agua, diamante (carbono), sal, azúcar, etc.
Los elementos son las sustancias fundamentales con las que se construyen todas las cosas materiales. La partícula más pequeña que conserva las propiedades del elemento se llama átomo. Todos los átomos del mismo elemento tienen igual número atómico. Un átomo no se puede descomponer para dar átomos mas sencillos (excepto en la fisión nuclear). Ejemplos: Oro (Au), potasio (K), sodio (Na), cloro (Cl), etc.
Los compuestos son sustancias puras que están formados por uno o más elementos combinados en proporciones fijas. Las propiedades de los compuestos son distintas a las de los elementos individuales que intervienen. Ejemplo: Agua (H2O), sal (NaCl), Ácido Sulfúrico (H2SO4), etc.
COMPOSICIÓN DE ALGUNOS COMPUESTOS COMUNES
NOMBRE DEL COMPUESTO
COMPOSICIÓN DEL COMPUESTO
COMPARACIÓN DE PROPIEDADES
AGUA
Hidrógeno y Oxígeno
El hidrógeno y el oxígeno son gases, pero el agua es líquida a temperatura ambiente.
AZÚCAR
Carbono, Hidrógeno y Oxígeno
El carbono puede ser un sólido negro, pero el hidrógeno y el oxígeno son gases incoloros. El compuesto azúcar es un sólido blanco de sabor dulce.
SAL DE MESA
Sodio y Cloro
El sodio e un metal sólido, plateado y reactivo; el cloro es un gas venenoso de color verde pálido. La sal es blanca, cristalina y sólida.
AMONIACO
Nitrógeno e hidrógeno
Los elementos son inodoros, pero el amoniaco tiene un olor fuerte.
*Las propiedades del compuesto NO SON la suma de las propiedades de los componentes.
SUSTANCIAS PURAS Y MEZCLAS
La composición de una mezcla puede variar, existen mezclas homogéneas y heterogéneas. Una mezcla homogénea tiene una composición y apariencia uniformes, por ejemplo: El aire, las aleaciones metálicas, las soluciones de alcohol y agua, etc. La mezcla heterogénea no presenta propiedades uniformes en toda ella, por ejemplo, el jugo de naranja, una sopa, grava en agua.
METODOS DE SEPARACIÓN DE MEZCLAS
La materia se encuentra en la naturaleza formando un conjunto de sistemas homogéneos y heterogéneos como compuestos, razón por la cual la química para separar los constituyentes de una mezcla emplea diferentes métodos según sean las sustancias a separar. Los principales métodos empleados son operaciones físicas o mecánicas como las siguientes:
MEZCLAS DE SÓLIDOS CON SÓLIDOS
a) Tamizado.- Tiene por objeto separar por tamaños las diferentes partículas que constituyen una mezcla, la cual previamente se hace pasar por una superficie perforada, la que detiene los trozos de mayor tamaño. Por ejemplo, la separación de grava de la tierra.
b) El arrastre por medio de agua.- La corriente de agua arrastra las partículas de menor densidad y deposita en un recipiente las partículas de mayor densidad. Por ejemplo, la extracción de oro de los ríos.
c) La flotación.- Permite la separación de minerales basándose en la modificación de la tensión superficial y, por lo tanto, del ángulo de contacto frente a una fase líquida, ya que algunas sustancias tienen la propiedad de no ser mojadas por el agua, debido a que sus superficies actúan como si estuviesen aceitosas. Por ejemplo, la espuma de los detergentes facilita la flotación de los minerales que pueden ser recogidos o se precipitan al fondo.
d) El magnetismo.- Los imanes atraen partículas de hierro y níquel en estado puro, no atrayendo a otros metales como zinc y cobre.
MEZCLAS DE SÓLIDOS CON LIQUIDOS
e) Decantación.- Se emplea para separar mezclas heterogéneas de sólidos y líquidos que no se disuelven. Se deja reposar la mezcla a fin de que las partículas sólidas se asienten. Una vez que el sólido se ha depositado en el fondo del recipiente, se vierte suavemente el líquido en otro recipiente evitando que el sólido se mezcle, quedando así separado el líquido del sólido.
f) Filtración.- Permite separar un sólido insoluble (de grano relativamente fino) de un líquido, utilizando un medio poroso de filtración o una membrana que deja pasar el líquido pero retiene el sólido.
g) Cristalización.- Este método consiste en provocar la separación de un sólido que se encuentra disuelto en una solución, mediante la cristalización del sólido. Este proceso involucra cambios de temperatura, agitación, eliminación del solvente, etc. Otra forma de lograr la cristalización es cuando la mezcla contiene un líquido volátil. Cuando el líquido se evapora el sólido se cristaliza.
h) Centrifugación.- Se usa para separar un líquido (insoluble, de grano muy fino, de difícil sedimentación) de un líquido. La operación se lleva a cabo en un aparato llamado centrífuga, en el que por medio de traslación acelerado se aumenta la fuerza gravitacional provocando la sedimentación del sólido o de las partículas de mayor densidad. Por ejemplo, la separación de los sólidos de la sangre del plasma.
- MEZCLA DE LÍQUIDOS CON LÍQUIDOS
i) Destilación.- Permite separar líquidos miscibles*, aprovechando sus diferentes puntos de ebullición. Incluye una evaporación y condensación sucesivas.
j) Embudo de separación.- Se usa para separar una mezcla de líquidos heterogénea.
* Miscibles: Que se mezcla un líquido con otro.
ENERGÍA
La energía se puede definir como la capacidad para realizar trabajo o transferir calor. Se realiza trabajo cuando se mueve una masa a través de una distancia. Entre las formas comunes de energía están la luz, la energía eléctrica, la energía mecánica y la energía química. La energía se puede convertir de una a otra, pero no se puede crear ni destruir (ley de la conservación de la energía).
Cada una de las diversas formas de energía se puede clasificar como energía potencial y energía cinética. La energía potencial es energía almacenada; es la energía que posee un objeto debido a su posición o a su composición química. Por ejemplo, La gasolina y el azúcar de mesa tienen energía potencial debido a su composición química. Un auto estacionado en una colina tiene energía potencial debido a su posición.
La energía cinética es energía de movimiento. Conforme un auto comienza a bajar por la colina, la energía potencial se va transformando en energía cinética. Desde el punto de vista matemático, la energía cinética (Ek) de un objeto es igual a la mitad de su masa multiplicada por el cuadrado de su velocidad.
Ek = ½mv2
La energía potencial almacenada en el azúcar y en otros tipos de alimentos, se libera cuando las células vivas utilizan el alimento en un proceso que se conoce como metabolismo. Este proceso es muy complejo, pero se resume en la ecuación:
metabolismo
AZÚCAR + OXÍGENO--------DIÓXIDO DE CARBONO + AGUA + ENERGÍA
Una reacción que libera energía calorífica se llama reacción exotérmica. Si libera energía distinta del calor se le llama exergónica. Cuando se incorpora o se absorbe calor u otras formas de energía durante las reacciones, se dice que éstas son endotérmicas y endergónicas respectivamente.
1. Describe porque una piedra en particular tiene más peso en la tierra que en la luna. ¿Cómo se compara la masa de la piedra en estos dos lugares?
2. El aceite vegetal y el agua son miscibles o no. Y el vinagre y el agua.
3. Compara las propiedades del ácido muriático (Solución de agua y HCl) con sus componentes (Hidrógeno y Cloro).
4. * Define los siguientes conceptos: Materia, sustancia pura, compuesto, mezcla homogénea y mezcla heterogénea.
Las preguntas 5 y 6 van juntas.
NOMBRE DEL COMPUESTO | COMPOSICIÓN DEL COMPUESTO | COMPARACIÓN DE PROPIEDADES |
AGUA | Hidrógeno y Oxígeno | El hidrógeno y el oxígeno son gases, pero el agua es líquida a temperatura ambiente. |
AZÚCAR | Carbono, Hidrógeno y Oxígeno | El carbono puede ser un sólido negro, pero el hidrógeno y el oxígeno son gases incoloros. El compuesto azúcar es un sólido blanco de sabor dulce. |
SAL DE MESA | Sodio y Cloro | El sodio e un metal sólido, plateado y reactivo; el cloro es un gas venenoso de color verde pálido. La sal es blanca, cristalina y sólida. |
AMONIACO |
Nitrógeno e hidrógeno | Los elementos son inodoros, pero el amoniaco tiene un olor fuerte. |
*Las propiedades del compuesto NO SON la suma de las propiedades de los componentes.
SUSTANCIAS PURAS Y MEZCLAS
La composición de una mezcla puede variar, existen mezclas homogéneas y heterogéneas. Una mezcla homogénea tiene una composición y apariencia uniformes, por ejemplo: El aire, las aleaciones metálicas, las soluciones de alcohol y agua, etc. La mezcla heterogénea no presenta propiedades uniformes en toda ella, por ejemplo, el jugo de naranja, una sopa, grava en agua.
METODOS DE SEPARACIÓN DE MEZCLAS
La materia se encuentra en la naturaleza formando un conjunto de sistemas homogéneos y heterogéneos como compuestos, razón por la cual la química para separar los constituyentes de una mezcla emplea diferentes métodos según sean las sustancias a separar. Los principales métodos empleados son operaciones físicas o mecánicas como las siguientes:
MEZCLAS DE SÓLIDOS CON SÓLIDOS
a) Tamizado.- Tiene por objeto separar por tamaños las diferentes partículas que constituyen una mezcla, la cual previamente se hace pasar por una superficie perforada, la que detiene los trozos de mayor tamaño. Por ejemplo, la separación de grava de la tierra.
b) El arrastre por medio de agua.- La corriente de agua arrastra las partículas de menor densidad y deposita en un recipiente las partículas de mayor densidad. Por ejemplo, la extracción de oro de los ríos.
c) La flotación.- Permite la separación de minerales basándose en la modificación de la tensión superficial y, por lo tanto, del ángulo de contacto frente a una fase líquida, ya que algunas sustancias tienen la propiedad de no ser mojadas por el agua, debido a que sus superficies actúan como si estuviesen aceitosas. Por ejemplo, la espuma de los detergentes facilita la flotación de los minerales que pueden ser recogidos o se precipitan al fondo.
d) El magnetismo.- Los imanes atraen partículas de hierro y níquel en estado puro, no atrayendo a otros metales como zinc y cobre.
MEZCLAS DE SÓLIDOS CON LIQUIDOS
e) Decantación.- Se emplea para separar mezclas heterogéneas de sólidos y líquidos que no se disuelven. Se deja reposar la mezcla a fin de que las partículas sólidas se asienten. Una vez que el sólido se ha depositado en el fondo del recipiente, se vierte suavemente el líquido en otro recipiente evitando que el sólido se mezcle, quedando así separado el líquido del sólido.
f) Filtración.- Permite separar un sólido insoluble (de grano relativamente fino) de un líquido, utilizando un medio poroso de filtración o una membrana que deja pasar el líquido pero retiene el sólido.
g) Cristalización.- Este método consiste en provocar la separación de un sólido que se encuentra disuelto en una solución, mediante la cristalización del sólido. Este proceso involucra cambios de temperatura, agitación, eliminación del solvente, etc. Otra forma de lograr la cristalización es cuando la mezcla contiene un líquido volátil. Cuando el líquido se evapora el sólido se cristaliza.
h) Centrifugación.- Se usa para separar un líquido (insoluble, de grano muy fino, de difícil sedimentación) de un líquido. La operación se lleva a cabo en un aparato llamado centrífuga, en el que por medio de traslación acelerado se aumenta la fuerza gravitacional provocando la sedimentación del sólido o de las partículas de mayor densidad. Por ejemplo, la separación de los sólidos de la sangre del plasma.
- MEZCLA DE LÍQUIDOS CON LÍQUIDOS
i) Destilación.- Permite separar líquidos miscibles*, aprovechando sus diferentes puntos de ebullición. Incluye una evaporación y condensación sucesivas.
j) Embudo de separación.- Se usa para separar una mezcla de líquidos heterogénea.
* Miscibles: Que se mezcla un líquido con otro.
ENERGÍA
La energía se puede definir como la capacidad para realizar trabajo o transferir calor. Se realiza trabajo cuando se mueve una masa a través de una distancia. Entre las formas comunes de energía están la luz, la energía eléctrica, la energía mecánica y la energía química. La energía se puede convertir de una a otra, pero no se puede crear ni destruir (ley de la conservación de la energía).
Cada una de las diversas formas de energía se puede clasificar como energía potencial y energía cinética. La energía potencial es energía almacenada; es la energía que posee un objeto debido a su posición o a su composición química. Por ejemplo, La gasolina y el azúcar de mesa tienen energía potencial debido a su composición química. Un auto estacionado en una colina tiene energía potencial debido a su posición.
La energía cinética es energía de movimiento. Conforme un auto comienza a bajar por la colina, la energía potencial se va transformando en energía cinética. Desde el punto de vista matemático, la energía cinética (Ek) de un objeto es igual a la mitad de su masa multiplicada por el cuadrado de su velocidad.
Ek = ½mv2
La energía potencial almacenada en el azúcar y en otros tipos de alimentos, se libera cuando las células vivas utilizan el alimento en un proceso que se conoce como metabolismo. Este proceso es muy complejo, pero se resume en la ecuación:
metabolismo
AZÚCAR + OXÍGENO--------DIÓXIDO DE CARBONO + AGUA + ENERGÍA
Una reacción que libera energía calorífica se llama reacción exotérmica. Si libera energía distinta del calor se le llama exergónica. Cuando se incorpora o se absorbe calor u otras formas de energía durante las reacciones, se dice que éstas son endotérmicas y endergónicas respectivamente.
1. Describe porque una piedra en particular tiene más peso en la tierra que en la luna. ¿Cómo se compara la masa de la piedra en estos dos lugares?
2. El aceite vegetal y el agua son miscibles o no. Y el vinagre y el agua.
3. Compara las propiedades del ácido muriático (Solución de agua y HCl) con sus componentes (Hidrógeno y Cloro).
4. * Define los siguientes conceptos: Materia, sustancia pura, compuesto, mezcla homogénea y mezcla heterogénea.
Las preguntas 5 y 6 van juntas.
5. * Clasifica las siguientes sustancias en elementos, compuestos o mezclas.
6. Agua, diamante, aluminio, acero, café (bebida), azúcar, cal, Bióxido de carbono, cóctel de frutas, titanio, agua con aceite, grafito, cal (óxido de calcio), aire.
5. * Clasifica las siguientes sustancias en elementos, compuestos o mezclas.
6. Agua, diamante, aluminio, acero, café (bebida), azúcar, cal, Bióxido de carbono, cóctel de frutas, titanio, agua con aceite, grafito, cal (óxido de calcio), aire.
7. * Las siguientes son propiedades características del cobre. Di cuales son químicas y cuales son físicas.
a. Se funde a
b. Su densidad es de 8.96 g/cm3
c. Es un buen conductor de calor y electricidad
d. Se vuelve verde cuando se expone al cloro
e. Es maleable
f. Se oxida con el aire
8. * Clasifica los que siguen como cambios físicos o cambios químicos
a) Prender un encendedor de butano
b) La expansión del agua cuando se congela
c) La evaporación del alcohol
d) El enmohecimiento de un clavo de hierro
e) El empañamiento de la plata
f) Sacar punta a un lápiz
g) La digestión de un caramelo
h) La fusión de la soldadura
9. Explica como es que la herrumbre de hierro (óxido de hierro) puede tener una masa mayor que el hierro original.
10.Indica cual método de separación de mezclas sería el más indicado para separar:
a. La grava de la arena
b. El plasma de la sangre
c. El azúcar de un café
d. El alcohol de las frutas fermentadas
e. La sal del agua salada
f. La grasa de un caldo de pollo
11.¿Cuáles de los cambios que siguen son exotérmicos y cuales son endotérmicos?
a) Un petardo cuando se enciende
b) Una vela que arde
c) Una planta que elabora azúcar por fotosíntesis
d) La fusión de la cera en torno de la mecha de una vela
e) El metabolismo del azúcar de un caramelo
f) Una corriente eléctrica que descompone el cloruro de sodio
g) La digestión de alimentos
h) La descomposición del agua por electrólisis* para obtener hidrógeno y oxígeno gaseosos. (*Investigar)
7. * Las siguientes son propiedades características del cobre. Di cuales son químicas y cuales son físicas.
a. Se funde a
b. Su densidad es de 8.96 g/cm3
c. Es un buen conductor de calor y electricidad
d. Se vuelve verde cuando se expone al cloro
e. Es maleable
f. Se oxida con el aire
8. * Clasifica los que siguen como cambios físicos o cambios químicos
a) Prender un encendedor de butano
b) La expansión del agua cuando se congela
c) La evaporación del alcohol
d) El enmohecimiento de un clavo de hierro
e) El empañamiento de la plata
f) Sacar punta a un lápiz
g) La digestión de un caramelo
h) La fusión de la soldadura
9. Explica como es que la herrumbre de hierro (óxido de hierro) puede tener una masa mayor que el hierro original.
10.Indica cual método de separación de mezclas sería el más indicado para separar:
a. La grava de la arena
b. El plasma de la sangre
c. El azúcar de un café
d. El alcohol de las frutas fermentadas
e. La sal del agua salada
f. La grasa de un caldo de pollo
11.¿Cuáles de los cambios que siguen son exotérmicos y cuales son endotérmicos?
a) Un petardo cuando se enciende
b) Una vela que arde
c) Una planta que elabora azúcar por fotosíntesis
d) La fusión de la cera en torno de la mecha de una vela
e) El metabolismo del azúcar de un caramelo
f) Una corriente eléctrica que descompone el cloruro de sodio
g) La digestión de alimentos
h) La descomposición del agua por electrólisis* para obtener hidrógeno y oxígeno gaseosos. (*Investigar)
FIN CLASE 1, 24/ABRIL/24
INICIO CLASE 2, 26/ABRIL/24
MODELO ATÓMICO, APLICACIONES Y LA TABLA PERIÓDICA
ÁTOMOS: LOS GRIEGOS
En los tiempos antiguos, los griegos creían que la materia estaba formada por una combinación de cuatro elementos: agua, aire, tierra y fuego.
Fueron los filósofos griegos Leucipo y su discípulo Demócrito* los primeros en sugerir la idea de los átomos. Leucipo pensaba que debían existir unas partículas diminutas que ya no se pudieran subdividir. Demócrito amplio esta idea y las llamó átomos.
La teoría atómica quedó en el olvido por mucho tiempo, en el que persistía de la idea de que la materia se podía dividir indefinidamente. Hasta que a principios del siglo XIX, el inglés John Dalton formula su famosa teoría.
* Demócrito imaginó que los átomos de agua podrían ser pelotas redondas y que los átomos de fuego tendrían bordes cortantes.
TEORÍA DE DALTON
- Todos los elementos están formados por partículas diminutas e indivisibles llamadas átomos. No es posible crear ni destruir átomos en una reacción química.
- Todos los átomos de un elemento dado son idénticos, pero difieren de los átomos de otros elementos.
- Los átomos de elementos distintos forman compuestos combinándose en proporciones fijas de números enteros pequeños, por ejemplo, 1 átomo de A con un átomo de B, 2 átomos de A con 1 átomo de B, 3 átomos de A con 2 átomos de B.
- Si los mismos elementos forman más de un compuesto, hay una proporción diferente, pero definida, y de números enteros pequeños, en masa y en átomos para cada compuesto.
- Una reacción química implica un cambio, no en los átomos mismos, sino en la forma en que se combinan los átomos para formar compuestos.
El primer punto, menciona que los mismos átomos que estaban presentes antes de una reacción química, deben estar presentes después de la reacción, enunciando la ley de la conservación de la materia de Antoine Laurent Lavoisier.
El segundo punto – que todos los átomos de un elemento dado son idénticos– y el tercero
– que los átomos se combinan en proporciones fijas de números enteros– explican en conjunto la ley de proporciones constantes de Joseph Louis Proust.
El cuarto punto resume la propia ley de Dalton, ley de proporciones múltiples. Como ciertos elementos pueden combinarse en dos o más proporciones de masa para formar compuestos distintos, estos elementos tienen, entonces, que combinarse en dos o más proporciones de átomos.
MODELO DE THOMSON
Fue muy importante el trabajo de dos científicos británicos, William Crookes y Joseph Thomson. En 1879, Crookes, estudiando la electricidad en tubos al vacío descubre unos rayos
que salen del polo negativo (cátodos), llamándolos rayos catódicos. En 1897 Thomson demostró que los rayos catódicos podían ser desviados por un campo eléctrico, hacia el lado positivo, lo que hacia suponer que tenían carga negativa, y les llamó electrones. Aunque Thomson no logró medir su carga (e) ni su masa (me), si consiguió medir la relación e/me.
e/me = -1.76 X 108 Coulombs/gramo
Para 1904 ya se había recabado información suficiente para sugerir que sin duda el átomo estaba formado por partículas más pequeñas, por lo que Thomson propone su modelo atómico llamado “budín de pasas”, las cargas negativas dispersas entre las cargas positivas.
MODELO DE RUTHERFORD
El neocelandés Ernesth Rutherford, descubrió que los rayos radiactivos estaban formados por tres tipos de rayos:
- Rayos alfa.- de masa 4 y carga +2
- Rayos Beta.- Son idénticos a los rayos catódicos, son corrientes de electrones.
- Parecidos a los rayos X, pero de mayor penetración.
En 1909, Hans Geiger le pide a Rutherford que sugiriera un proyecto de investigación para Earnest Marsden, un joven estudiante de 20 años, la recordación fue investigar el efecto de las partículas alfa sobre hojas delgadas de metal de diversos grosores. Días después, Geiger acudió emocionado con Rutherford y le explico lo que había observado al utilizar una hoja de oro. Casi todas las partículas alfa atravesaban la hoja metálica, pero algunas se desviaban de manera abrupta, unas pocas partículas llegaron a rebotar hacia atrás.
En 1911, Rutherford concluye que toda la carga positiva y la totalidad de masa se encontraban en un núcleo extremadamente diminuto, lo que explicaba las desviaciones abruptas.
PARTÍCULAS FUNDAMENTALES
En 1932 el físico inglés descubre el neutrón como una partícula con masa aproximada a la del protón pero sin carga, completando la lista de “tabiques” que forman el átomo.
PARTÍCULAS SUBATÓMICAS
Partícula
Símbolo
Masa (UMA)*
Carga
Localización en el átomo
Protón
P+
1
+1
Núcleo
Neutrón
n
1
0
Núcleo
Electrón
e-
1 / 1837
-1
Fuera del núcleo
*1 UMA (Unidad de Masa Atómica) equivales a 1.6 X 10-.
NÚMERO ATÓMICO Y MASA ATÓMICA
El número atómico está dado por el número de protones que tiene el átomo. Si este es neutro, éste número también equivale al número de electrones.
Ejemplo: ¿Cuántos protones y electrones tiene el átomo neutro de Ca?
Solución: Como el número atómico del calcio es 20, entonces cada átomo de calcio tiene 20 protones, y como es neutro también tendrá 20 electrones.
La masa atómica de un átomo está dada por la suma del número de protones más el número de neutrones del átomo.
Ejemplo: ¿Cuántos neutrones tiene el átomo de Na-23?
Solución: El átomo de sodio (Na) tiene un número atómico de 11, por lo que tiene 11 protones, y como la masa atómica es 23, se resta 23 – 11 = 12, que es el número de neutrones.
ISÓTOPOS
Son átomos del mismo elemento que tienen distinta masa atómica, es decir, distinto número de neutrones. Las propiedades químicas de dos distintos isótopos de un mismo elemento son idénticas, no así algunas propiedades físicas.
Ejemplo: El hidrógeno está formado por una combinación de tres distintos isótopos; El hidrógeno normal (protio) H-1, el deuterio H-2 y el Tritio H-3. Dos isótopos del carbono son C-12 y C-14, este último es radiactivo.
El hidrógeno es el único elemento que tiene nombres y símbolos diferentes para cada uno de los isótopos, como se explicita en la tabla adjunta:
Símbolo
Nombre
Etimología
nº de neutrones
Descubierto
Masa atómica
Número atómico
H o H-1
protio
primero
0
1766
1
1
D o H-2
deuterio
segundo
1
1932
2
1
T o H-3
tritio
tercero
2
1934
3
1
El protio se encuentra en más del 99.98% del elemento natural; el deuterio se encuentra en la naturaleza aproximadamente en un 0.02% y el tritio aparece en pequeñas cantidades en la naturaleza, pero puede producirse artificialmente por medio de varias reacciones nucleares.
TEORIA ATÓMICA MODERNA
En 1900, el alemán Max Planck propone la teoría cuántica, en el cual los átomos absorben y emiten energía de manera discontinua, en paquetes llamados “cuantos” (quantum = cantidad elemental). También determinó que la energía que puede absorber o emitir un átomo es proporcional a la frecuencia de la energía emitida o absorbida.
E = hu
Donde E es la energía de un cuanto, u es la frecuencia de la radiación y h es la constante de Planck, que vale, 6.62 X 10-34 joules«seg.
En 1913 el científico danés Niels Bohr propuso un modelo atómico basado en la teoría cuántica de Planck, sus bases fueron:
- Los electrones en los átomos solo presentan ciertos estados energéticos estables (bandas de energía), por lo que solo ciertas órbitas eran factibles.
- Las leyes del electromagnetismo clásico no son del todo válidas en el nivel atómico. Aunque los electrones son partículas cargadas, no emiten radiación en su viaje alrededor del núcleo, sino solamente cuando cambian el radio de su órbita.
Las siguientes son consecuencias del modelo atómico de Bohr:
a) La energía del electrón en el átomo está cuantizada, es decir, no puede adoptar cualquier valor.
b) La emisión y absorción de luz por los átomos se explica por el tránsito del electrón entre dos de los estados energéticos permitidos.
c) Existe un estado de mínima energía llamado estado basal.
d) El radio de la órbita menor es de 53 picómetros* (pm). El núcleo es unas diez mil veces menor que el átomo mismo.
e) El número entero n, o número cuántico principal, es suficiente para especificar la órbita del electrón y su energía. Si n crece, el electrón gira más lejos del núcleo y con mayor energía.
* 1 pm = 1 X 10-12 m.
MODELOS DE ORBITALES
Actualmente, se manejan modelos en base a la probabilidad. Un orbital es una región del espacio cercano al núcleo con alta probabilidad de contener al menos un electrón. Para determinar estas regiones, el austriaco Erwin Shrodinger, combinó la naturaleza del electrón, sus propiedades ondulatorias y las restricciones cuánticas en una función de probabilidad, en unas ecuaciones que calculan el movimiento de los electrones.
PRINCIPIO DE EXCLUSIÓN DE PAULI
Un orbital puede contener como máximo 2 electrones, y esto solo si tienen spín (giro) contrario.
SUBNIVELES DE ENERGÍA
El uso de la mecánica cuántica, cada nivel de energía de un átomo está formado por uno o más subniveles. El primer nivel principal tiene solo un subnivel, el segundo nivel energético tiene dos subniveles, y sucesivamente el nivel energético n tiene n subniveles.
Cada subnivel tiene uno o más orbitales, que poseen una forma tridimensional específica. Los orbitales se designan con las letras minúsculas s, p, d y f.
Los subniveles tipo s, tienen un solo orbital, por lo que pueden tener como máximo 2 electrones. Son de forma esférica.
Los subniveles tipo p tienen forma de mancuerna con dos lóbulos orientados a lo largo del eje donde la densidad electrónica es máxima. Poseen tres orbitales y, como máximo, 6 electrones.
Los orbitales tipo d, tienen 5 orbitales y, como máximo, 10 electrones.
Los orbitales tipo f, tienen 7 orbitales y, como máximo, 14 electrones.
REGLA DE HUND
Indica el orden de llenado de los orbitales. Los primeros orbitales en llenarse son los de menor energía, posteriormente se llenaran los de energía creciente sucesivamente. De acuerdo al siguiente diagrama:
MODELO ATÓMICO, APLICACIONES Y LA TABLA PERIÓDICA
ÁTOMOS: LOS GRIEGOS
En los tiempos antiguos, los griegos creían que la materia estaba formada por una combinación de cuatro elementos: agua, aire, tierra y fuego.
Fueron los filósofos griegos Leucipo y su discípulo Demócrito* los primeros en sugerir la idea de los átomos. Leucipo pensaba que debían existir unas partículas diminutas que ya no se pudieran subdividir. Demócrito amplio esta idea y las llamó átomos.
La teoría atómica quedó en el olvido por mucho tiempo, en el que persistía de la idea de que la materia se podía dividir indefinidamente. Hasta que a principios del siglo XIX, el inglés John Dalton formula su famosa teoría.
* Demócrito imaginó que los átomos de agua podrían ser pelotas redondas y que los átomos de fuego tendrían bordes cortantes.
TEORÍA DE DALTON
- Todos los elementos están formados por partículas diminutas e indivisibles llamadas átomos. No es posible crear ni destruir átomos en una reacción química.
- Todos los átomos de un elemento dado son idénticos, pero difieren de los átomos de otros elementos.
- Los átomos de elementos distintos forman compuestos combinándose en proporciones fijas de números enteros pequeños, por ejemplo, 1 átomo de A con un átomo de B, 2 átomos de A con 1 átomo de B, 3 átomos de A con 2 átomos de B.
- Si los mismos elementos forman más de un compuesto, hay una proporción diferente, pero definida, y de números enteros pequeños, en masa y en átomos para cada compuesto.
- Una reacción química implica un cambio, no en los átomos mismos, sino en la forma en que se combinan los átomos para formar compuestos.
El primer punto, menciona que los mismos átomos que estaban presentes antes de una reacción química, deben estar presentes después de la reacción, enunciando la ley de la conservación de la materia de Antoine Laurent Lavoisier.
El segundo punto – que todos los átomos de un elemento dado son idénticos– y el tercero
– que los átomos se combinan en proporciones fijas de números enteros– explican en conjunto la ley de proporciones constantes de Joseph Louis Proust.
El cuarto punto resume la propia ley de Dalton, ley de proporciones múltiples. Como ciertos elementos pueden combinarse en dos o más proporciones de masa para formar compuestos distintos, estos elementos tienen, entonces, que combinarse en dos o más proporciones de átomos.
MODELO DE THOMSON
Fue muy importante el trabajo de dos científicos británicos, William Crookes y Joseph Thomson. En 1879, Crookes, estudiando la electricidad en tubos al vacío descubre unos rayos
que salen del polo negativo (cátodos), llamándolos rayos catódicos. En 1897 Thomson demostró que los rayos catódicos podían ser desviados por un campo eléctrico, hacia el lado positivo, lo que hacia suponer que tenían carga negativa, y les llamó electrones. Aunque Thomson no logró medir su carga (e) ni su masa (me), si consiguió medir la relación e/me.
e/me = -1.76 X 108 Coulombs/gramo
Para 1904 ya se había recabado información suficiente para sugerir que sin duda el átomo estaba formado por partículas más pequeñas, por lo que Thomson propone su modelo atómico llamado “budín de pasas”, las cargas negativas dispersas entre las cargas positivas.
MODELO DE RUTHERFORD
El neocelandés Ernesth Rutherford, descubrió que los rayos radiactivos estaban formados por tres tipos de rayos:
- Rayos alfa.- de masa 4 y carga +2
- Rayos Beta.- Son idénticos a los rayos catódicos, son corrientes de electrones.
- Parecidos a los rayos X, pero de mayor penetración.
En 1909, Hans Geiger le pide a Rutherford que sugiriera un proyecto de investigación para Earnest Marsden, un joven estudiante de 20 años, la recordación fue investigar el efecto de las partículas alfa sobre hojas delgadas de metal de diversos grosores. Días después, Geiger acudió emocionado con Rutherford y le explico lo que había observado al utilizar una hoja de oro. Casi todas las partículas alfa atravesaban la hoja metálica, pero algunas se desviaban de manera abrupta, unas pocas partículas llegaron a rebotar hacia atrás.
En 1911, Rutherford concluye que toda la carga positiva y la totalidad de masa se encontraban en un núcleo extremadamente diminuto, lo que explicaba las desviaciones abruptas.
PARTÍCULAS FUNDAMENTALES
En 1932 el físico inglés descubre el neutrón como una partícula con masa aproximada a la del protón pero sin carga, completando la lista de “tabiques” que forman el átomo.
PARTÍCULAS SUBATÓMICAS | ||||
Partícula | Símbolo | Masa (UMA)* | Carga | Localización en el átomo |
Protón | P+ | 1 | +1 | Núcleo |
Neutrón | n | 1 | 0 | Núcleo |
Electrón | e- | 1 / 1837 | -1 | Fuera del núcleo |
*1 UMA (Unidad de Masa Atómica) equivales a 1.6 X 10-.
NÚMERO ATÓMICO Y MASA ATÓMICA
El número atómico está dado por el número de protones que tiene el átomo. Si este es neutro, éste número también equivale al número de electrones.
Ejemplo: ¿Cuántos protones y electrones tiene el átomo neutro de Ca?
Solución: Como el número atómico del calcio es 20, entonces cada átomo de calcio tiene 20 protones, y como es neutro también tendrá 20 electrones.
La masa atómica de un átomo está dada por la suma del número de protones más el número de neutrones del átomo.
Ejemplo: ¿Cuántos neutrones tiene el átomo de Na-23?
Solución: El átomo de sodio (Na) tiene un número atómico de 11, por lo que tiene 11 protones, y como la masa atómica es 23, se resta 23 – 11 = 12, que es el número de neutrones.
ISÓTOPOS
Son átomos del mismo elemento que tienen distinta masa atómica, es decir, distinto número de neutrones. Las propiedades químicas de dos distintos isótopos de un mismo elemento son idénticas, no así algunas propiedades físicas.
Ejemplo: El hidrógeno está formado por una combinación de tres distintos isótopos; El hidrógeno normal (protio) H-1, el deuterio H-2 y el Tritio H-3. Dos isótopos del carbono son C-12 y C-14, este último es radiactivo.
El hidrógeno es el único elemento que tiene nombres y símbolos diferentes para cada uno de los isótopos, como se explicita en la tabla adjunta:
Símbolo | Nombre | Etimología | nº de neutrones | Descubierto | Masa atómica | Número atómico |
H o H-1 | protio | primero | 0 | 1766 | 1 | 1 |
D o H-2 | deuterio | segundo | 1 | 1932 | 2 | 1 |
T o H-3 | tritio | tercero | 2 | 1934 | 3 | 1 |
El protio se encuentra en más del 99.98% del elemento natural; el deuterio se encuentra en la naturaleza aproximadamente en un 0.02% y el tritio aparece en pequeñas cantidades en la naturaleza, pero puede producirse artificialmente por medio de varias reacciones nucleares.
TEORIA ATÓMICA MODERNA
En 1900, el alemán Max Planck propone la teoría cuántica, en el cual los átomos absorben y emiten energía de manera discontinua, en paquetes llamados “cuantos” (quantum = cantidad elemental). También determinó que la energía que puede absorber o emitir un átomo es proporcional a la frecuencia de la energía emitida o absorbida.
E = hu
Donde E es la energía de un cuanto, u es la frecuencia de la radiación y h es la constante de Planck, que vale, 6.62 X 10-34 joules«seg.
En 1913 el científico danés Niels Bohr propuso un modelo atómico basado en la teoría cuántica de Planck, sus bases fueron:
- Los electrones en los átomos solo presentan ciertos estados energéticos estables (bandas de energía), por lo que solo ciertas órbitas eran factibles.
- Las leyes del electromagnetismo clásico no son del todo válidas en el nivel atómico. Aunque los electrones son partículas cargadas, no emiten radiación en su viaje alrededor del núcleo, sino solamente cuando cambian el radio de su órbita.
Las siguientes son consecuencias del modelo atómico de Bohr:
a) La energía del electrón en el átomo está cuantizada, es decir, no puede adoptar cualquier valor.
b) La emisión y absorción de luz por los átomos se explica por el tránsito del electrón entre dos de los estados energéticos permitidos.
c) Existe un estado de mínima energía llamado estado basal.
d) El radio de la órbita menor es de 53 picómetros* (pm). El núcleo es unas diez mil veces menor que el átomo mismo.
e) El número entero n, o número cuántico principal, es suficiente para especificar la órbita del electrón y su energía. Si n crece, el electrón gira más lejos del núcleo y con mayor energía.
* 1 pm = 1 X 10-12 m.
MODELOS DE ORBITALES
Actualmente, se manejan modelos en base a la probabilidad. Un orbital es una región del espacio cercano al núcleo con alta probabilidad de contener al menos un electrón. Para determinar estas regiones, el austriaco Erwin Shrodinger, combinó la naturaleza del electrón, sus propiedades ondulatorias y las restricciones cuánticas en una función de probabilidad, en unas ecuaciones que calculan el movimiento de los electrones.
PRINCIPIO DE EXCLUSIÓN DE PAULI
Un orbital puede contener como máximo 2 electrones, y esto solo si tienen spín (giro) contrario.
SUBNIVELES DE ENERGÍA
El uso de la mecánica cuántica, cada nivel de energía de un átomo está formado por uno o más subniveles. El primer nivel principal tiene solo un subnivel, el segundo nivel energético tiene dos subniveles, y sucesivamente el nivel energético n tiene n subniveles.
Cada subnivel tiene uno o más orbitales, que poseen una forma tridimensional específica. Los orbitales se designan con las letras minúsculas s, p, d y f.
Los subniveles tipo s, tienen un solo orbital, por lo que pueden tener como máximo 2 electrones. Son de forma esférica.
Los subniveles tipo p tienen forma de mancuerna con dos lóbulos orientados a lo largo del eje donde la densidad electrónica es máxima. Poseen tres orbitales y, como máximo, 6 electrones.
Los orbitales tipo d, tienen 5 orbitales y, como máximo, 10 electrones.
Los orbitales tipo f, tienen 7 orbitales y, como máximo, 14 electrones.
REGLA DE HUND
Indica el orden de llenado de los orbitales. Los primeros orbitales en llenarse son los de menor energía, posteriormente se llenaran los de energía creciente sucesivamente. De acuerdo al siguiente diagrama:
CONFIGURACIÓN ELECTRÓNICA
Los electrones de los átomos en estado basal ocupan primero los subniveles de más baja energía, pero es conveniente disponer de alguna forma para representar esta distribución de manera concisa; a esta representación se le llama configuración electrónica. Se puede utilizar un diagrama de orbitales para representar la distribución de electrones dentro de los orbitales.
Ejemplo: Hallar la configuración electrónica de los siguientes átomos:
- 1H = 1s1 tiene un electrón de valencia
- 5B = 1s2, 2s2, 2p1 tiene 3 electrones de valencia (2s2 y 2p1)
- 12Mg = 1s2, 2s2, 2p6, 3s2 tiene 2 electrones de valencia
- 30Zn = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10 tiene 2 electrones de valencia (4s2)
- 88Ra = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2. Tiene 2 electrones de valencia.
PARTICIPACIÓN 2
Hallar la configuración electrónica de los siguientes átomos:
Pb:
F:
Ru:
I:
Xe:
Y:
Br:
S:
Ca:
Ga:
Los electrones de los átomos en estado basal ocupan primero los subniveles de más baja energía, pero es conveniente disponer de alguna forma para representar esta distribución de manera concisa; a esta representación se le llama configuración electrónica. Se puede utilizar un diagrama de orbitales para representar la distribución de electrones dentro de los orbitales.
Ejemplo: Hallar la configuración electrónica de los siguientes átomos:
- 1H = 1s1 tiene un electrón de valencia
- 5B = 1s2, 2s2, 2p1 tiene 3 electrones de valencia (2s2 y 2p1)
- 12Mg = 1s2, 2s2, 2p6, 3s2 tiene 2 electrones de valencia
- 30Zn = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10 tiene 2 electrones de valencia (4s2)
- 88Ra = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2. Tiene 2 electrones de valencia.
PARTICIPACIÓN 2
Hallar la configuración electrónica de los siguientes átomos:
Pb:
F:
Ru:
I:
Xe:
Y:
Br:
S:
Ca:
Ga:
TAREA 2
1. *Hallar la configuración electrónica de los siguientes elementos:
a) Rb b) Ta c) V d) N e) Cu
f) Ge g) Ce h) Hg i) Os h) Po
1. *Hallar la configuración electrónica de los siguientes elementos:
a) Rb b) Ta c) V d) N e) Cu
f) Ge g) Ce h) Hg i) Os h) Po
2.- Realizar la maqueta de algún (Átomo) Elemento de la Tabla Periódica o Compuesto.
Tomar mínimo, 5 fotos de como se realizo.
FIN CLASE 2, 26/ABRIL/24
INICIO CLASE 3, 3/MAYO/24
LA TABLA PERIÓDICA
Para el año de 1830, había 55 elementos conocidos, todos con propiedades distintas en apariencia y sin un orden evidente. En 1817 J. W. Dobereiner, profesor de química en Alemania, demostró que la masa del estroncio se acerca mucho al promedio de las masas atómicas de dos metales similares, el calcio y el bario. Más tarde encontró otras tríadas de elementos similares, como litio, sodio y potasio, o cloro, bromo y yodo. Dobereiner recomendó que se clasificaran los elementos por tríadas, pero no consiguió encontrar suficientes de ellas para que el sistema fuera útil
La distribución más exitosa de los elementos fue desarrollada por Dimitri Ivanovich Mendeleev, profesor ruso de química, quien señaló que tanto las propiedades físicas como las propiedades químicas de los elementos varían en forma periódica conforme aumenta el número de masa. Esto se le conoce como ley periódica.
Mendeleev publicó una tabla periódica de los elementos que es muy parecida a la tabla periódica moderna. En su tabla, los elementos estaban ordenados por masa atómica creciente, y en periodos, de modo que los elementos con propiedades químicas similares aparecían agrupados, aunque había algunos casos en los que tuvo que colocar un elemento con masa atómica un poco mayor antes de un elemento con masa más ligeramente inferior.
Mendeleev dejó algunos huecos en su tabla, audazmente predijo la existencia de elementos que aún no habían sido descubiertos, incluso sus propiedades. En vida de Mendeleev se descubrieron varios elementos nuevos, entre ellos, el escandio, el germanio y el galio.
Aunque a Mendeleev se le reconoce el descubrimiento de la tabla periódica, Lothar Meyer, químico alemán, había desarrollado de manera independiente su propia tabla periódica en 1868, pero su trabajo no se publicó hasta 1870, un año después de la publicación de Medeleev.
LA TABLA PERIÓDICA ACTUAL
Desde la época de Mendeleev, la tabla periódica ha sufrido muchos cambios para incluir nuevos elementos, valores más exactos y diferentes formas de rotular las columnas de los elementos de la tabla.
Unos cuantos años después de las investigaciones de Rutherford respecto al núcleo, Henry Moseley desarrolló una técnica para determinar la magnitud de la carga positiva de un núcleo. Concluyó que cada elemento difiere de todos los demás en que tiene un número distinto de protones (número atómico). En la actualidad los elementos se ordenan en las tablas periódicas por número atómico, en vez de hacerlo por masa atómica.
METALES Y NO METALES
Los químicos dividen a los elementos en metales y no metales, la base de esta división son sus propiedades físicas y químicas.
En general, los metales tienen las propiedades físicas y químicas siguientes:
Propiedades físicas y químicas de los metales | |
a) Brillo
| b) La mayoría son duros (algunos son suaves. |
c) Son buenos conductores de calor y electricidad | d) No es fácil combinarlos |
e) Son dúctiles y maleables | f) No se combinan entre sí |
g) Tienen densidades altas | h) Tienen altos puntos de fusión |
Las propiedades físicas y químicas antes mencionadas son propiedades generales que varían de un metal a otro. Por lo general los metales presentan estas propiedades, aunque no necesariamente todas.
Las propiedades físicas y químicas de los no metales son las siguientes:
Propiedades físicas y químicas de los no metales | |
a) Son opacos
| b) Son blandos |
c) Son malos conductores de calor y electricidad | d) Se combinan con los metales
|
e) No son dúctiles ni maleables | f) Se pueden combinar entre sí
|
g) Tienen bajas densidades |
|
Se llaman metaloides a los elementos que presentan propiedades intermedias entre metales y no metales, entre ellos están el boro, antimonio, arsénico, telurio, polonio, etc.
NOMBRES Y SÍMBOLOS
Muchos de los símbolos primitivos que se empleaban para representar diversas sustancias químicas proceden de la mitología antigua, pero los símbolos no habían sido normalizados.
En 1814 el sueco J. J. Berzelius, introdujo un sistema sencillo de notación, sus símbolos eran letras tomadas del nombre del elemento, este sistema es el utilizado hasta hoy.
Los símbolos químicos no tienen más de tres letras, donde la primera es mayúscula y las demás son minúsculas. Algunos símbolos derivan de palabras latinas, griegas o alemanas.
NOMBRE | SIGNIFICADO |
Magnesio (Mg) | De Magnesia, comarca de Tesalia (Grecia). |
Vanadio (V) | Vanadis, diosa escandinava. |
Cobre (Cu) | Cuprum, de la isla de Chipre. |
Galio (Ga): | De Gallia, Francia. |
Germanio(Ge) | De Germania, Alemania. |
Selenio (Se): | De Selene, la Luna. |
Estroncio (Sr): | Strontian, ciudad de Escocia. |
Berilio (Be) | De beriio, esmeralda de color verde. |
Hidrógeno (H) | Engendrador de agua. |
Nitrógeno (N) | Engendrador de nitratos (nitrum) |
Oxígeno (O): | Formador de ácidos (oxys) |
Cloro (Cl) | Del griego chloros (amarilio verdoso). |
Argón (Ar) | Argos, inactivo. (Ya sabes, los gases nobles son poco reactivos). |
Bromo (Br): | Del griego bromos, hedor, peste. |
Zinc (Zn): | Del aleman zink, que significa origen oscuro. |
Yodo (I): | Del griego iodes, violeta. |
Oro (Au): | De aurum, aurora respiandeciente. |
Bario (Ba): | Del griego barys, pesado. |
Helio (He): | De la atmostera del sol (helios, se descubrió por primera vez en el espectro de la corona solar durante un eclipse en 1868, aunque la mayoría de los científicos no lo aceptaron hasta que se aisló en la tierra). |
Litio (Li): | De lithos, roca. |
Boro (B): | Del arabe buraq. |
Carbono (C): | Carbón. |
Fluor (F): | De fluere (fluir).. |
Neón (Ne). | Nuevo (del griego neos). |
Aluminio (Al): | Del latín alumen (alumbre). |
Silicio (Si) | Silex, sílice. |
Fósforo (P) | phosphoros, portador de luz (el fosforo emite luz en la obscuridad porque arde al combinarse lentamente con el oxígeno del aire). |
Azufre (S) | Del latín sulphurium. |
Potasio (K) | Kalium; el nombre, del inglés pot ashes (cenizas). (Las cenizas de algunas plantas son ricas en potasio). |
Calcio (Ca) | De calx, caliza. (La caliza está formada por Ca2CO3). |
Hierro (Fe): | De ferrum. |
Cobalto (Co): | Proviene de cobalos, mina. |
Plata (Ag): | Del latín argentum. |
PERIÓDOS Y GRUPOS
La tabla periódica actual está ordenada en 7 renglones horizontales llamados periodos y 18 columnas verticales llamados grupos o familias. El número del periodo determina el número del último nivel de energía principal que los electrones comienzan a llenar, mientras que los elementos que se encuentran en un determinado grupo son semejantes porque tienen propiedades químicas similares.
Puesto que los grupos tienen propiedades semejantes, también tienen nombres especiales. Algunos de ellos son;
Grupo 1A (excepto el hidrógeno) | También se llaman metales alcalinos. |
Grupo 2A | También se llaman metales alcalinotérreos. |
Grupo VIA | También se llaman calcógenos. |
Grupo VIIA | También se llaman halógenos. |
Grupo VIIIA | También se llaman gases nobles. |
Analizando los periodos se tiene lo siguiente:
a) Periodo 1.- Contiene solo dos elementos, el hidrógeno y el helio. En este periodo se llena el primer nivel de energía. |
|
b) Periodo 2.- Contiene 8 elementos, desde el litio hasta el neón. Este periodo llena el segundo nivel de energía (2s y 2p). |
|
c) Periodo 3.- Contiene 8 elementos, desde el sodio hasta el argón. Este periodo llena el tercer nivel de energía (3s y 3p). |
|
d) Periodo 4.- Contiene 18 elementos, desde el potasio hasta el kriptón. Este periodo llena los subniveles 4s, 4p y 3d. El subnivel 3d se llena a partir del zinc. |
|
e) Periodo 5.- Contiene 18 elementos, desde el rubidio hasta el xenón. Este periodo llena los subniveles 5s, 5p y 4d. |
|
f) Periodo 6.- Contiene 32 elementos, desde el cesio hasta el radón. Este periodo llena a los subniveles 6s, 6p, 4d, y . Contiene a los lantánidos. |
|
g) Periodo 7.- Contiene actualmente 32 elementos, desde el francio hasta el oberón (descubierto recientemente). Este periodo llena los subniveles 7s, 6d y . Contiene a los actínidos. |
CARACTERÍSTICAS GENERALES DE LOS GRUPOS
Uno de los principios fundamentales en química es el uso de la tabla periódica para correlacionar las características generales de los elementos. A continuación veremos 5 características generales de los grupos.
1. La tabla periódica separa a los metales de los no metales por medio de una línea escalonada. A la derecha se encuentran los no metales y a la izquierda, los metales. Los elementos que están adyacentes a la línea se llaman metaloides, excepto el aluminio.
2. Los electrones de valencia* determinan el número de grupo al que pertenecen. Por ejemplo el sodio (1s2, 2s2 2p6, 3s1), Pertenece al grupo 1ª. El azufre (1s2, 2s2, 2p6, 3s2, 3p4) tiene 6 electrones de valencia (3s2, 3p4) y pertenece al grupo VIA. Una excepción es el helio (1s2), pues, tiene 2 electrones de valencia y pertenece al grupo VIIIA. Esta característica general no la tienen los elementos de transición. * El número de valencia está dado por el número de electrones de la última capa.
3. Los elementos que pertenecen al mismo grupo tienen propiedades químicas y configuraciones electrónicas similares. Por ejemplo todos los metales alcalinos terminan en s1, Todos los gases nobles saturan su capa exterior (el helio con 2 y los demás con 8 electrones).
4. En los elementos del grupo A, las propiedades metálicas aumentan conforme se incrementan los números atómicos y al mismo tiempo las propiedades no metálicas disminuyen.
5. Existe un cambio gradual en muchas de las propiedades físicas y químicas dentro de los elementos de un mismo grupo, según va aumentando su número atómico. Por ejemplo, en los halógenos, el punto de fusión y ebullición, las densidades y los radios atómicos aumentan a medida que se incrementa el número atómico.
TAMAÑO ATÓMICO Y TAMAÑO IÓNICO (Radio atómico - pm)
251-300 |
| 201-250 |
| 151-200 |
| 101-150 |
| 51-100 |
| Desconocido |
|
|
|
|
|
|
|
|
|
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| Ia | IIa | IIIb | IVb | Vb | VIb | VIIb | VIII | Ib | IIb | IIIa | IVa | Va | VIa | VIIa | 0 | ||||||||||||||||||
1 | 1 78 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 128 | ||||||||||||||||
2 | 3 152 | 4 112 |
|
|
|
|
|
|
|
|
|
| 5 88 | 6 77 | 7 74 | 8 66 | 9 64 | 10
| ||||||||||||||||
3 | 11 191 | 12 160 |
|
|
|
|
|
|
|
|
|
| 13 143 | 14 118 | 15 110 | 16 104 | 17 99 | 18 174 | ||||||||||||||||
4 | 19 235 | 20 197 | 21 164 | 22 147 | 23 135 | 24 129 | 25 137 | 26 128 | 27 125 | 28 125 | 29 128 | 30 137 | 31 153 | 32 122 | 33 121 | 34 119 | 35 114 | 36
| ||||||||||||||||
5 | 37 250 | 38 215 | 39 182 | 40 160 | 41 147 | 42 140 | 43 135 | 44 134 | 45 134 | 46 137 | 47 144 | 48 152 | 49 167 | 50 158 | 51 141 | 52 137 | 53 133 | 54 218 | ||||||||||||||||
6 | 55 272 | 56 224 | 188 | 72 159 | 73 147 | 74 141 | 75 137 | 76 135 | 77 136 | 78 139 | 79 144 | 80 155 | 81 171 | 82 175 | 83 182 | 84 167 | 85
| 86
| ||||||||||||||||
7 | 87 270 | 88 223 | 188 | 104 150 | 105 139 | 106 132 | 107 128 | 108 126 | 109
| 110
| 111
| 112
| 113
| 114
| 115
| 116
| 117
| 118
| ||||||||||||||||
|
| Serie lantánidos | 58 183 | 59 183 | 60 182 | 61 181 | 62 180 | 63 204 | 64 180 | 65 178 | 66 177 | 67 177 | 68 176 | 69 175 | 70 194 | 71 172 | ||||||||||||||||||
|
| Serie actínidos | 90 180 | 91 161 | 92 138 | 93 131 | 94 151 | 95 184 | 96 174 | 97 170 | 98 169 | 99 203 | 100
| 101
| 102
| 103
| ||||||||||||||||||
No es posible establecer el radio o volumen exacto de un átomo porque no es una esfera dura con límite definido. Así, el radio atómico se basa en la distancia media entre los electrones externos y el núcleo. La variación del tamaño es una propiedad periódica. Observa que el máximo lo representan los radios de los metales alcalinos.
La variación del tamaño atómico se resume como sigue:
 |
Un ión es una partícula cargada que se produce cuando un átomo o grupo de átomos gana o pierde uno o más electrones. Los átomos de los metales, los cuales tienen casi todos menos de 4 electrones de valencia, tienden a perder esos electrones para formar iones positivos llamados cationes. Al perder esos electrones externos, el radio disminuye casi a la mitad.
ÁTOMO | IÓN |
| ÁTOMO | IÓN |
Li 152 |
Li 60 |
| K 231 | K
133 |
Na
186 | Na
95 |
| Rb
244 | Rb
148 |
Comparación de los radios y sus iones, las medidas están en picómetros.
1. Que es UMA
2. Analizando las configuraciones atómicas:
a) ¿Que tienen en común las configuraciones de los metales alcalinos?
b) ¿Qué tienen en común las configuraciones de los gases nobles?
c) ¿Qué tienen en común las configuraciones de los lantánidos y actínidos?
3. ¿Cuál es el grupo de elementos de la tabla periódica que presenta el tamaño atómico mayor? ¿Y el menor?
4. ¿Cuál es la tendencia en el tamaño atómico de los átomos de izquierda a derecha en el periodo 2?
5. Compara el tamaño de un átomo de Ca y un ión de Ca+2.
6. Compara el tamaño de un átomo de S y un ión de S-2.
LEER TODO PARA PROXIMA CLASE Y CONTESTAR LAS SIGUIENTES PREGUNTAS
ENERGÍA DE IONIZACIÓN
Se requiere una cantidad específica de energía para extraer un electrón de un átomo neutro, pues los electrones se hallan en niveles de energía definidos. La cantidad de energía necesaria para extraer un electrón de un átomo gaseoso en su estado basal es la energía de ionización. Es una propiedad periódica de los elementos, y es una medida de que tan estrechamente están unidos los electrones a los átomos.
Se puede representar la ionización de un átomo de sodio, por ejemplo, mediante la ecuación:
Na + Energía = Na+ + 1 e-
Cuando se suministra la energía suficiente para “arrancar” un electrón de valencia, se produce un ión de sodio, junto a un electrón libre. La energía necesaria para extraer el electrón que está unido a él con menos fuerza se conoce como primera energía de ionización. Se requiere más energía para extraer cada electrón adicional porque la carga positiva aumenta en una unidad con cada electrón subsecuente que se extrae. La energía de ionización se puede expresar en diversas unidades de energía, entre ellas, kilojoules por mol, kilocalorías por mol, electrón-volts por átomo.
Se realizan las generalizaciones siguientes: (IM)
Los elementos de carácter más metálico (grupo IA) presentan las energías de ionización mas bajas.
La electronegatividad es otra de las propiedades periódicas de los elementos químicos, tiene una relación directa con las energías de ionización. Ver la tabla de la pag 40.
Energía de ionización
En kJ.mol-1
2001-2500 |
| 1501-2000 |
| 1001-1500 |
| 501-1000 |
| 1-500 |
| Desconocido |
|
|
|
|
|
|
|
|
|
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Ia | IIa | IIIb | IVb | Vb | VIb | VIIb | VIII | Ib | IIb | IIIa | IVa | Va | VIa | VIIa | 0 | ||
1 | 1 1310 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 2370 |
2 | 3 519 | 4 899 |
|
|
|
|
|
|
|
|
|
| 5 799 | 6 1090 | 7 1400 | 8 1310 | 9 1680 | 10 2080 |
3 | 11 494 | 12 736 |
|
|
|
|
|
|
|
|
|
| 13 577 | 14 786 | 15 1011 | 16 1000 | 17 1255 | 18 1520 |
4 | 19 418 | 20 590 | 21 631 | 22 658 | 23 650 | 24 653 | 25 717 | 26 759 | 27 760 | 28 737 | 29 785 | 30 906 | 31 577 | 32 784 | 33 947 | 34 941 | 35 1140 | 36 1350 |
5 | 37 402 | 38 548 | 39 616 | 40 660 | 41 664 | 42 685 | 43 702 | 44 | 45 720 | 46 805 | 47 | 48 868 | 49 556 | 50 707 | 51 834 | 52 870 | 53 1008 | 54 1170 |
6 | 55 376 | 56 503 | 538 | 72 642 | 73 761 | 74 770 | 75 760 | 76 840 | 77 | 78 870 | 79 890 | 80 1007 | 81 590 | 82 716 | 83 703 | 84 812 | 85 930 | 86 1036 |
7 | 87 400 | 88 509 | 499 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 |
|
| Serie lantánidos | 58 527 | 59 523 | 60 530 | 61 536 | 62 543 | 63 547 | 64 592 | 65 565 | 66 572 | 67 581 | 68 589 | 69 597 | 70 603 | 71 524 |
|
| Serie actínidos | 90 587 | 91 568 | 92 584 | 93 597 | 94 585 | 95 578 | 96 581 | 97 601 | 98 608 | 99 619 | 100 627 | 101 635 | 102 642 | 103 |
7. Describe el descubrimiento de la radiactividad y los rayos X.
8. *Explica el significado de: Isótopo, número atómico, masa atómica, UMA, estado basal, configuración electrónica, electrones de valencia, orbital.
9. ¿Qué significa “primera energía de ionización”?
10. De cada par de elementos elige aquel con la menor energía de ionización:
C y Ge | Cd y Sn | Ag y Cu | Hg y Pt | In y Ga |
Os y Ba | Gd y Dy | Zn y Hg | Br y Ca | N y P |
11.De cada par de elementos elige aquel con el mayor tamaño atómico.
C y Ge | Cd y Sn | Ag y Cu | Hg y Pt | In y Ga |
Os y Ba | Gd y Dy | Zn y Hg | Br y Ca | N y P |
12.Suponga que descubrió el elemento 120. ¿A que grupo pertenecerá? Escribe al menos 5 propiedades físicas o químicas de este elemento.
13.Investiga las propiedades principales de los elementos de los siguientes grupos:
Grupo 1A | También se llaman metales alcalinos. |
Grupo 2A | También se llaman metales alcalinotérreos. |
Grupo VIA | También se llaman calcógenos. |
Grupo VIIA | También se llaman halógenos. |
Grupo VIIIA | También se llaman gases nobles. |
14.Investiga que es la electronegatividad.
15.Investiga otras propiedades periódicas de los elementos y su variación.
16.*Utilice la tabla periódica para clasificar a los siguientes elementos en metales, no metales o metaloides, según sea el caso.
A) Cesio B) Iridio C) Oxígeno D) Germanio E) Selenio
F) Argón G) Uranio H) Azufre I) Cloro J) Plomo
K) Nitrógeno L) Osmio M) Galio N) Arsénico O) Francio
17.Utilice la tabla periódica para indicar la cantidad de electrones de valencia que existen en los siguientes elementos:
A) Cesio B) Iridio C) Oxígeno D) Germanio E) Selenio
F) Argón G) Uranio H) Azufre I) Cloro J) Plomo
K) Nitrógeno L) Osmio M) Galio N) Arsénico O) Francio
18.Agrupe en parejas a los elementos cuyas configuraciones sean semejantes (Tienen los mismos electrones de valencia).
1. Al | 2. Na | 3. Cl | 4. Rb | 5. Cr | 6. O | 7. S | 8. Ca | 9. P | 10. V |
11. Sb | 12. W | 13. Zn | 14. Al | 15. Ga | 16. Hg | 17. Br | 18. Ba | 20. Nb |
19.¿Que es la radiactividad?
PARTICIPACIÓN 6
COMPUESTOS TERNARIOS Y SUPERIORES
Para nombrar y escribir la fórmula de los compuestos ternarios y superiores, seguimos el mismo procedimiento que utilizamos para los compuestos binarios, con la salvedad que para este caso usamos el nombre o la fórmula del ión poliatómico. Se llaman así a aquellos iones formados por más de un elemento. Algunos iones poliatómicos comunes son:
FÓRMULA
NOMBRE
FORMULA
NOMBRE
FÓRMULA
NOMBRE
FÓRMULA
NOMBRE
C2H3O2-1
Acetato
HCO3-1
Carbonato ácido o bicarbonato
MnO4-1
Permanganato
SO4-2
Sulfato
*ClO-1
Hipoclorito
HSO3-1
Sulfito ácido o bisulfito
CO3-2
Carbonato
PO3-3
Fosfito
*ClO2-1
Clorito
HSO4-1
Sulfato ácido o bisulfato
C2O4-2
Oxalato
PO4-3
Fosfato
*ClO3-1
Clorato
OH-1
Hidróxido
CrO4-2
Cromato
*ClO4-1
Perclorato
NO2-1
Nitrito
Cr2O7-2
Dicromato
CN-1
Cianuro
NO3-1
Nitrato
SO3-2
Sulfito
*En este tipo de compuestos se puede sustituir el cloro por cualquier halógeno.
Ejemplo: Dar nombre a los siguientes compuestos.
a) Na NO3 Nitrato de sodio
b) K H SO3 Sulfito ácido de potasio o bisulfito de potasio
c) Al2 (CO3)2 Carbonato de aluminio
d) Cu3 PO4 Fosfato cuproso
e) Cu3 (PO4)2 Fosfato cúprico
Para nombrar y escribir la fórmula de los compuestos ternarios y superiores, seguimos el mismo procedimiento que utilizamos para los compuestos binarios, con la salvedad que para este caso usamos el nombre o la fórmula del ión poliatómico. Se llaman así a aquellos iones formados por más de un elemento. Algunos iones poliatómicos comunes son:
*En este tipo de compuestos se puede sustituir el cloro por cualquier halógeno. Ejemplo: Dar nombre a los siguientes compuestos. a) Na NO3 Nitrato de sodio b) K H SO3 Sulfito ácido de potasio o bisulfito de potasio c) Al2 (CO3)2 Carbonato de aluminio d) Cu3 PO4 Fosfato cuproso e) Cu3 (PO4)2 Fosfato cúprico |
ÁCIDOS
Un ácido es un compuesto de hidrógeno que en solución acuosa produce iones de hidrógeno (H+).
ACIDOS BINARIOS O HIDRÁCIDOS
Los ácidos binarios son la combinación de un no metal o anión (por lo general un halógeno) e hidrógeno.
H+
Anión =
Hidrácido
Para nombrarlos, la terminación –uro del anión se sustituye por la terminación –hídrico, anteponiendo la palabra ácido.
Ejemplo: Dar nombre a los siguientes compuestos.
a) HCl Acido clorhídrico
b) HBr Ácido Bromhídrico
c) H2S Ácido Sulfhídrico
OXÁCIDOS
Los oxácidos están formados por un ión poliatómico negativo e hidrógeno.
H+
Ión poliatómico negativo =
Oxácido
Para nombrarlos se utiliza el nombre del ión poliatómico, cambiando las terminaciones –ito y –ato por –oso e –ico respectivamente.
Ejemplo: Nombrar los siguientes compuestos.
a) H3PO4 Acido fosfórico; la terminación –ato (fosfato) se cambio por –ico (fosfórico).
b) HNO2 Acido Nitroso; la terminación –ito (nitrito) se cambio por –oso (nitroso)
c) H2C2O4 Ácido oxálico; la terminación –ato (oxalato) se cambio por –ico (oxálico).
BASES O HIDRÓXIDOS
Una base es un compuesto formado por un ión metálico y uno o más iones hidróxido (OH-).
Ión metálico + OH- = Hidróxido o base
Para nombrarlos, se escribe la palabra hidróxido seguido del nombre del ión metálico.
Ejemplo: Nombrar los siguientes compuestos.
a) Na OH Hidróxido de sodio
b) Mg (OH)2 Hidróxido de magnesio
c) Pb (OH)2 Hidróxido plumboso o hidróxido de plomo (II)
d) Pb (OH)4 Hidróxido plúmbico o hidróxido de plomo (IV)
SALES
Las sales son compuestos iónicos formados por un ión con carga positiva (catión) y un ión con carga negativa (anión). Son ejemplos de sales los compuestos binarios de cationes metálicos con aniones no metálicos y los compuestos ternarios formados por cationes metálicos o iones amonio con iones poliatómicos negativos. Así pues, son sales, el cloruro de sodio (NaCl), el sulfato de plata (Ag2SO4), el bicarbonato mercúrico {Hg (HCO3)2}, etc.
ÁCIDOS Un ácido es un compuesto de hidrógeno que en solución acuosa produce iones de hidrógeno (H+). ACIDOS BINARIOS O HIDRÁCIDOS Los ácidos binarios son la combinación de un no metal o anión (por lo general un halógeno) e hidrógeno.
Para nombrarlos, la terminación –uro del anión se sustituye por la terminación –hídrico, anteponiendo la palabra ácido. Ejemplo: Dar nombre a los siguientes compuestos. a) HCl Acido clorhídrico b) HBr Ácido Bromhídrico c) H2S Ácido Sulfhídrico OXÁCIDOS Los oxácidos están formados por un ión poliatómico negativo e hidrógeno.
Para nombrarlos se utiliza el nombre del ión poliatómico, cambiando las terminaciones –ito y –ato por –oso e –ico respectivamente. Ejemplo: Nombrar los siguientes compuestos. a) H3PO4 Acido fosfórico; la terminación –ato (fosfato) se cambio por –ico (fosfórico). b) HNO2 Acido Nitroso; la terminación –ito (nitrito) se cambio por –oso (nitroso) c) H2C2O4 Ácido oxálico; la terminación –ato (oxalato) se cambio por –ico (oxálico). BASES O HIDRÓXIDOS Una base es un compuesto formado por un ión metálico y uno o más iones hidróxido (OH-). Ión metálico + OH- = Hidróxido o base Para nombrarlos, se escribe la palabra hidróxido seguido del nombre del ión metálico. Ejemplo: Nombrar los siguientes compuestos. a) Na OH Hidróxido de sodio b) Mg (OH)2 Hidróxido de magnesio c) Pb (OH)2 Hidróxido plumboso o hidróxido de plomo (II) d) Pb (OH)4 Hidróxido plúmbico o hidróxido de plomo (IV) SALES Las sales son compuestos iónicos formados por un ión con carga positiva (catión) y un ión con carga negativa (anión). Son ejemplos de sales los compuestos binarios de cationes metálicos con aniones no metálicos y los compuestos ternarios formados por cationes metálicos o iones amonio con iones poliatómicos negativos. Así pues, son sales, el cloruro de sodio (NaCl), el sulfato de plata (Ag2SO4), el bicarbonato mercúrico {Hg (HCO3)2}, etc. |
10. Explique el significado de: Enlace, enlace iónico, enlace covalente, enlaces polares, puentes de hidrógeno y electronegatividad.
11. Complete la tabla escribiendo la fórmula correcta y el nombre de los compuestos que se forman al combinarse los iones correspondientes (Observa el ejemplo).
| Cloruro | Carbonato | Sulfito | Fosfato | Cianuro |
Potasio |
|
|
|
|
|
Bario |
|
|
|
|
|
Aluminio |
| Al2(CO3)3 Carbonato de aluminio |
|
|
|
Hierro (III) |
|
|
|
|
|
Cobre (II) |
|
|
|
|
|
TAREA 6
Ver los siguientes videos y copiarlos, a la libreta de apuntes.
ATOMO, ION E ISOTOPOS. NUMERO ATÓMICO, NUMERO DE MASA . CATIONES Y ANIONES. ESTRUCTURA ATOMICA - YouTube
METALES y NO METALES 🔒🔗 Tabla Periódica - YouTube
NOMENCLATURA CLASICA PARA OXIDOS, HIDRUROS, HIDROXIDOS Y ACIDOS. NOMENCLATURA TRADICIONAL - YouTube
PARTICIPACIÓN 7
1. *Calcule los números de oxidación del elemento que se indica en cada uno de los siguientes compuestos o iones:
a) Br en HBrO
a) Br en HBrO | b) N en HNO2 | c) S en HSO3- | d) S en SO4-2 |
e) I en IO2- | f) I en HIO3 | g) S en H2S | h) Bi en BiO3- |
i) As en AsO4-3 | j) P en P2O7-4 | k) B en H2B4O7 | l) Cl en Mg(ClO)2 |
2. Dibuje el diagrama de la estructura iónica de los siguientes iones, indique la cantidad de protones y de neutrones que hay en el núcleo y acomode los electrones en los niveles principales de energía.
a) 1H+ b) 9Be+2 c) 24Mg+2 d) 23Na+ e) 27Al+3
f) 19F- g) 16O-2 h) 32S-2 i) 14N-3 j) 31P-3
3. El radio del átomo de O es de 66 pm, y el de O-2 es de 140 pm. Explique este cambio de tamaño.
TAREA 7
12.- Escribir los nombres, de los siguientes Compuestos Binarios,
Con dos No Metales S3F4 y Cl6P5.
13.- Escribir los nombres, de los siguientes Compuestos,
Metales con Carga Iónica fija, CaLi y Cd3Al2.
14.- Escribir los nombres, de los siguientes Compuestos,
Metales con Carga Iónica Variable, Cu2O y Fe2Pb4.
15.- Dar 8 nombres, de Compuestos Ternarios y Superiores,
Con su formula y Nomenclatura.
16.- Definir que son, las Sales y dar tres ejemplos.
17.- Definir que son, Hidróxidos o Bases, y dar tres ejemplos.
18.- Definir que son, los Ácidos y dar tres ejemplos.
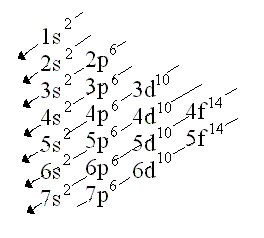







Comentarios
Publicar un comentario